Eksperci o opiniowaniu badań klinicznych produktów leczniczych (wideo)
Kilkadziesiąt osób pracujących w komisjach bioetycznych na terenie całego kraju uczestniczyło w konferencji pt. „Cztery lata po uchwaleniu nowych europejskich przepisów o opiniowaniu badań klinicznych produktów leczniczych”.
Foto: Mariusz Tomczak
Spotkanie organizowane przez Ośrodek Bioetyki Naczelnej Rady Lekarskiej odbyło się 7 grudnia w siedzibie samorządu lekarskiego.
– Ta konferencja ma doprowadzić do tego, by polskie prawo dostosować do przepisów prawa i sytuacji obowiązującej w Unii Europejskiej. Nie jest to proste, bo m.in. autonomia uczelni sprawia, że działanie komisji jest różnorodne – powiedział prezes Naczelnej Rady Lekarskiej prof. Andrzej Matyja, rozpoczynając konferencję komisji bioetycznych.
O czym rozmawiali eksperci? Początek spotkania zdominował problem systemowego uregulowania finansowania działalności komisji bioetycznych. Zdaniem przewodniczącego Ośrodka Bioetyki NRL dr. hab. Marka Czarkowskiego, skala naszego kraju determinuje pewne rozwiązania w zakresie finansowania. – Nie wolno wymagać od żadnej komisji bioetycznych, by opiniowała 500 projektów rocznie – podkreślił dr hab. Marek Czarkowski.
Aktualny stan prac nad ustawą o badaniach klinicznych zaprezentował dyrektor Departamentu Polityki Lekowej i Farmacji Ministerstwa Zdrowia Łukasz Szmulski. Podkreślił, że jednym z powodów zmiany unijnych przepisów kilka lat temu była chęć harmonizacji procesu oceny wniosków o pozwolenie na prowadzenie badań klinicznych w państwach członkowskich UE oraz zwiększenie transparentności i wiarygodności danych pochodzących z badań klinicznych.
– Zachęcam do zgłaszania uwag w trybie konsultacji społecznych – zaapelował Łukasz Szmulski, kończąc swoje wystąpienie, po czym wywiązała się kilkunastominutowa dyskusja. Zwrócono w niej uwagę, że wciąż nierozwiązany jest problem finansowania komisji bioetycznych, który wydaje się znacznie poważniejszy niż nowelizacja rozporządzenia. Pojawił się również głos, aby w znacznie większym stopniu do komisji powoływać nie-lekarzy (np. farmakologów).
Najważniejsze cele rozporządzenia Parlamentu Europejskiego Rady (UE) nr 536/2014 z dnia 16 kwietnia 2014 r. w sprawie badań klinicznych produktów leczniczych stosowanych u ludzi oraz uchylenia dyrektywy 2001/20/WE przybliżyła Ewa Ołdak z Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Najważniejsze cele to:
- uproszczenie i harmonizacja przepisów administracyjnych regulujących badania kliniczne (ograniczenie do minimum różnic w podejściu do rejestracji badań klinicznych między państwami członkowskimi),
- zharmonizowana dokumentacja związana z procedurą wydawania pozwoleń (jeden portal służący do składania wniosków o pozwolenie na rozpoczęcie badania klinicznego wraz z bazą danych),
- określone ramy czasowe na każdy etap procesu wydawania pozwolenia, możliwość zgody domniemanej,
- zaangażowanie we wspólną ocenę wszystkich państw, w których sponsor planuje przeprowadzić dane badanie kliniczne.
Aby usprawnić proces prowadzenia badań klinicznych, Europejska Agencja Leków (EMA) tworzy na zlecenie Komisji Europejskiej portal i bazę danych. Jak podkreśliła Ewa Ołdak, funkcjonalność systemu jest niezbędna, aby rozporządzenie Parlamentu Europejskiego Rady (UE) nr 536/2014 zaczęło być stosowane w praktyce.
W przyszłości cały proces rejestracji i oceny prowadzony ma być właśnie za pośrednictwem portalu EMA. Interfejs użytkownika bazy danych ma być dostępny we wszystkich językach urzędowych UE. Dostęp do określonej dokumentacji będzie związany z nadanymi uprawnieniami i rolą „odgrywaną” w procesie wydawania pozwolenia. – Portal ma być bardzo przyjazny dla użytkowników. Będzie można śledzić cały proces rejestracji – podkreśliła Ewa Ołdak.
O tym, co w kontekście komisji bioetycznych zmienią planowane przepisy wprowadzające ustawę Prawo o szkolnictwie wyższym i nauce, mówiła Elżbieta Olesińska z Departamentu Nauki i Szkolnictwa Wyższego Ministerstwa Zdrowia. Wśród korzyści wymieniła:
- zapewnienie wysokich standardów etycznych w zakresie prowadzenia badań naukowych, jako elementu kształcenia specjalistycznego kadr medycznych w uczelniach publicznych z nowo powołanymi kierunkami kształcenia w zakresie nauk medycznych i nauk o zdrowiu oraz w uczelniach niepublicznych z kierunkami kształcenia w zakresie nauk medycznych i nauk o zdrowiu,
- tworzenie jednolitego systemu weryfikacji formalnej badań naukowych – eksperymentów medycznych, prowadzonych w uczelniach publicznych i niepublicznych jako narzędzia regulującego wysoki poziom etyczny badań w obszarze nauk medycznych i nauk o zdrowiu,
- komisje bioetyczne w uczelni niepublicznej, podobnie jak dotychczas w uczelni publicznej, są strażnikami dobrych praktyk w zakresie działalności naukowo-badawczej w medycynie i ochronie zdrowia, kreując misję zawodów medycznych.
Wśród zadań dla ministra właściwego do spraw zdrowia, wynikających z przepisów wprowadzających ustawę Prawo o szkolnictwie wyższym i nauce, będzie nie tylko znowelizowanie rozporządzenia Ministra Zdrowia i Opieki Społecznej w sprawie szczegółowych zasad powoływania i finansowania oraz trybu działania komisji bioetycznych (Dz.U. z 1999 r. Nr 47, poz. 480), ale również przeprowadzanie dyskusji nad podjęciem inicjatywy legislacyjnej w kierunku rozszerzenia możliwości prowadzenia badań naukowych (w rozumieniu eksperymentu badawczego) przez innych specjalistów – poza lekarzami i lekarzami dentystami – kształconymi w zakresie nauk medycznych i nauk o zdrowiu.
Wielowątkowa dyskusja wywiązała się nad zasadnością udziału pacjentów i przedstawicieli środowisk organizacji pacjenckich w opiniowaniu badania klinicznego. Zdaniem dr. hab. Marka Czarkowskiego nie należy tworzyć pozorów, dlatego wydaje się zasadne, aby zajmowali się tym pacjenci chorujący na tę samą chorobę, których dotyczy badanie.
– Błędem jest utożsamianie laika z pacjentem – podkreślił kierownik Centrum Bioetyki i Bioprawa w Instytucie Filozofii Uniwersytetu Warszawskiego prof. Paweł Łuków, dodając, że pacjent nie musi być członkiem organizacji pacjenckich, ale może byłoby zasadne przeprowadzenie szkoleń dla pacjentów uczestniczących w opiniowaniu. Wśród głosów przedstawionych w czasie dyskusji pojawiły się też takie, że nadmierne rozszerzanie składów komisji nie przysłuży się efektywnym pracom komisji.
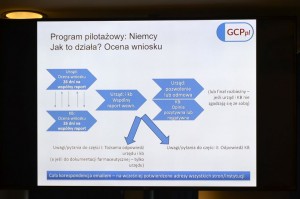
Czy w realiach nowego rozporządzenia unijnego należałoby rozpocząć w naszym kraju program pilotażowy w zakresie opiniowanie badań klinicznych? Jak to zrobić wobec braku pełnej jasności co do przyszłej ustawy „okołorozporządzeniowej”? Kto miałby zawiadywać projektem? Na to pytanie próbował odpowiedzieć dr Piotr Iwanowski z zarządu Stowarzyszenia na Rzecz Dobrej Praktyki Badań Klinicznych w Polsce. Przyczynkiem do postawienia takiego pytania jest pilotaż prowadzony w Niemczech i w Czechach.
Konferencję zakończyło walne zebranie Stowarzyszenia Członków i Pracowników Komisji Bioetycznych w Polsce.