Ubytki kostne będą odbudowane. Czy to przełom w leczeniu osteoporozy?
Ten wynalazek może zrewolucjonizować leczenie osteoporozy. Polscy naukowcy opracowali materiał, który pomoże odbudowywać ubytki kostne i jednocześnie może służyć jako nośnik leków na osteoporozę.
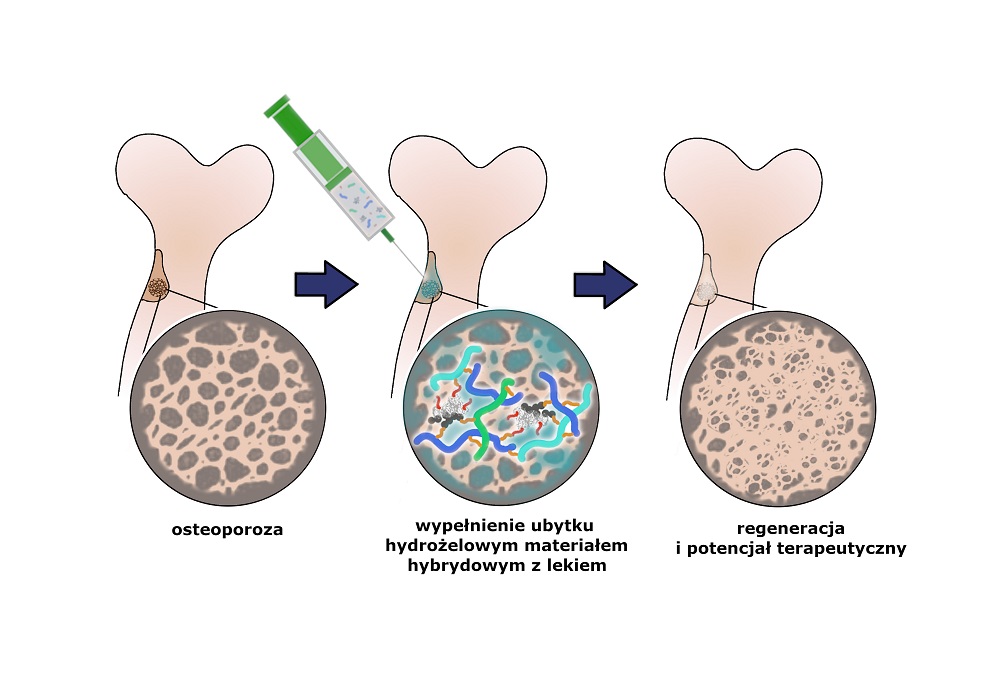
Zespół naukowców z Wydziału Chemii Uniwersytetu Jagiellońskiego pod kierunkiem prof. Marii Nowakowskiej stworzył wielofunkcyjny materiał, którego przeznaczeniem jest udoskonalenie metod leczenia osteoporozy oraz niwelowanie niedużych ubytków kostnych.
Jak dowiedziała się „Gazeta Lekarska”, nowy materiał ma postać hydrożelu, który wstrzykuje się w miejsce ubytku kości, gdzie następnie dochodzi do jego „zestalenia” w wyniku sieciowania chemicznego zachodzącego w temperaturze 37 st. C. Ze względu na swoją strukturę i skład hydrożel trwale przyczepia się do tkanki kostnej i pełni funkcję rusztowania, na którym w naturalnych procesach biologicznych tworzy się nowa tkanka kostna wypełniająca ubytek.
Podać lek tam, gdzie jest potrzebny
Naukowcy zaprojektowali również dodatkową funkcję dla nowego materiału. Skład chemiczny hydrożelu pozwala, by stał się on nośnikiem leków na osteoporozę, które da się podać miejscowo wyłącznie w okolice chorych tkanek i ubytków kostnych. Naukowcy przekonują, że opracowana przez nich metoda daje dwie zasadnicze korzyści.
Po pierwsze, pozwala odejść od ogólnoustrojowego podawania leków na osteoporozę, które mają silne skutki uboczne. Po drugie, hydrożel daje możliwość aplikowania znacznie większych stężeń leku w bezpośrednie sąsiedztwo chorych tkanek i tym samym zwiększenia efektywności terapii. Przy okazji, ze względu na swoje właściwości, dodatkowo pojawiają się szanse na naturalną odbudowę kości w miejscu ubytków.
Naturalny skład tkanki kostnej
– Komponenty naszego hydrożelu naśladują naturalny skład tkanki kostnej. Wśród jego składników jest między innymi kolagen, kwas hialuronowy oraz chitozan, czyli polisacharyd o udowodnionych właściwościach antybakteryjnych, przeciwzapalnych i przeciwbólowych. Oprócz tego w jego skład wchodzi kluczowy składnik nieorganiczny. Jest nim syntetyzowany przez nas układ cząstek krzemionki dekorowanych hydroksyapatytem, który w hydrożelu i projektowanej terapii pełni kilka istotnych i pożytecznych funkcji. Składowe hydrożelu, po jego wstrzyknięciu, już w organizmie, wiążą się ze sobą wiązaniami kowalencyjnymi. Właściwość ta pozwala podać hydrożel nieinwazyjną drogą a cały materiał zachowuje swoją funkcjonalność, ponieważ nie ulega niekontrolowanej degradacji – wyjaśnia dr hab. Joanna Lewandowska-Łańcucka z Wydziału Chemii UJ, współtwórczyni wynalazku.
– Wykorzystany w hydrożelu hydroksyapatyt w organizmach żywych stanowi główny, nieorganiczny budulec tkanki kostnej, wpływając na jej wytrzymałość. W naszym materiale pełni on analogiczną rolę. Minerał ten odpowiednio zagęszcza preparat, który po wstrzyknięciu łatwo przywiera do tkanki kostnej w miejscu ubytku i służy za podłoże dla osteoblastów, które odbudowują kość. To jednak tylko skromna część naszej innowacji. Prawdziwie przełomowe odkrycie dotyczy możliwości związania w hydrożelu alendronianu sodu, czyli popularnie stosowanego leku na osteoporozę, uzyskując w ten sposób wielofunkcyjny materiał o potencjale terapeutycznym. Dzięki tym właściwościom lekarze poprzez wstrzyknięcie hydrożelu będą mogli aplikować lek bezpośrednio w chore miejsca, gdzie będzie on stopniowo uwalniany – dodaje dr Adriana Gilarska, współtwórczyni wynalazku, nad którym pracowała w ramach swojej rozprawy doktorskiej na Wydziale Chemii UJ.
Obiecujące testy
Zespół naukowy jest już po badaniach na modelu mysim. Celem testów było wykazanie szeroko pojętej biokompatybilności hydrożelu w warunkach in vivo. Naukowcy dowiedli, że preparat można wstrzyknąć i że nie wywołuje on efektu toksycznego. Ponadto wykazano, że w miejscu podania hydrożelu zachodzi naturalna angiogeneza, czyli powstawanie włosowatych naczyń krwionośnych. To wskazuje na możliwość realnego wykorzystania tego materiału jako bazy dla odbudowujących się tkanek kostnych.
Sam hydrożel także ulega naturalnej, stopniowej degradacji. Badania in vivo były prowadzone przez 60 dni i w ostatnim dniu w miejscu podania hydrożelu wciąż były widoczne jego pozostałości. Co więcej, w badaniach in vitro potwierdzono, że podany w hydrożelu lek – alendronian sodu – jest uwalniany do organizmu stopniowo, co dodatkowo może zwiększać skuteczność leczenia.
– Pierwsze testy hydrożelu na liniach komórkowych i modelach zwierzęcych wypadły bardzo obiecująco. Na razie planujemy przeznaczyć ten materiał do projektowania terapii mniejszych ubytków kostnych, spowodowanych przede wszystkim osteoporozą, ale również różnego rodzaju urazami czy ubytków, jakie powstają na przykład w wyniku operacji neurologicznych. Materiał powinien więc zainteresować szerokie grono lekarzy reumatologów, ortopedów, jak również neurologów i stomatologów – mówi dr Gabriela Konopka-Cupiał, dyrektor CITTRU – Centrum Transferu Technologii UJ.
Konieczne badania kliniczne
Jak dowiaduje się redakcja „Gazety Lekarskiej”, obecnie zespół naukowy poszukuje możliwości współpracy z inwestorami, którzy zaangażowaliby się w dalszy rozwój wynalazku i w niezbędne do przeprowadzenia badania kliniczne. Naukowcy nie wykluczają zarówno komercjalizacji pośredniej na przykład poprzez założenie spółki spin-off, jak również realizacji kolejnych prac rozwojowych z pomocą finansowania ze źródeł Narodowego Centrum Badań i Rozwoju lub Narodowego Centrum Nauki. Wskazują, że konieczne jest ostateczne przeprowadzenie badań toksykologicznych, wykonanie testów na większych zwierzętach, jak również określenie optymalnych stężeń alendronianu sodu dla uzyskania jak najlepszych rezultatów terapeutycznych.
Dawkowanie leków na osteoporozę
Twórcy hydrożelu obecnie pracują nad dalszymi modyfikacjami krzemionki wykorzystywanej w jego składzie, tak by zwiększyć możliwości zarządzania przyszłymi planami leczenia osteoporozy. – Dzięki uzyskanemu projektowi Tango V – ścieżka A, finansowanemu ze środków Narodowego Centrum Badań i Rozwoju, możemy w dalszym ciągu rozwijać naszą technologię – mówi dr hab. Joanna Lewandowska-Łańcucka.
– Udało nam się zsyntetyzować dekorowane hydroksyapatytem i odpowiednio sfunkcjonlizowane mezoporowate cząstki krzemionki, co pozwala zaadsorbować i związać w hydrożelu kilkukrotnie większą ilość leku na osteoporozę. Badania wykazały, że użycie tego rodzaju cząstek pozwoli nie tylko znacznie zwiększać stężenie alendronianu sodu w pobliżu chorych miejsc, ale że porowata struktura będzie spowalniać proces uwalniania leku, co może wydłużyć w czasie jego działanie. To oznacza, że w przyszłości lekarze będą mogli precyzyjnie projektować zarówno moc, jak i czasochłonność terapii, w zasadzie całkowicie eliminując skutki uboczne, jakie niesie z sobą ogólnoustrojowe podawanie leku. Ze względu na wydajniejszy załadunek lekiem ale także, co warte podkreślenia, przyspieszony proces dekoracji hydroksyapatytem ta udoskonalona wersja bioaktywnego nośnika posiada znacznie większy potencjał aplikacyjny – wyjaśnia dr hab. Joanna Lewandowska-Łańcucka.
Zniwelowane skutki uboczne
Dlaczego miejscowe podawanie leku na osteoporozę jest tak ważne? Alendronian sodu jest skutecznym lekiem w walce z tym schorzeniem. Jego działanie polega na łączeniu się z hydroksyapatytami kości, przy czym sam lek hamuje aktywność osteoklastów, czyli komórek kości, które odpowiadają za degradację tkanki kostnej. Nie hamuje on natomiast działania osteoblastów, które kość budują. Sprzyja więc naturalnej odbudowie kości.
W osteoporozie tkanka kostna ulega systematycznej degradacji, tracąc swoją masę i nieustannie się osłabiając. Z czasem w kościach pojawiają się ubytki, które zwiększają ryzyko uszkodzenia bądź złamania. Powstrzymać ten proces można poprzez wyhamowanie aktywności osteoklastów, wzmożenie aktywności osteoblastów lub poprzez równoczesne wdrożenie obu tych działań.
Ochrona patentowa
Alendronian wprawdzie hamuje osteoporozę, natomiast w dotychczas stosowanych terapiach podawany jest głównie doustnie, przez co działa ogólnoustrojowo, a jako lek wykazuje szereg niepożądanych skutków ubocznych. Ogólnoustrojowe stosowanie leku o niepożądanych skutkach ubocznych powoduje, że ma on stosunkowo niską dostępność biologiczną – w chorych miejscach można osiągnąć jedynie jego niskie stężenia. To powoduje, że konieczne jest ścisłe przestrzeganie zaleceń w zakresie stosowania tego leku, a same terapie są długotrwałe i nie zawsze przynoszą zadowalające rezultaty.
Kluczowe więc jest uzyskanie zdolności do podawania leku miejscowo, dokładnie tam, gdzie jest to potrzebne, z pominięciem reszty organizmu. W optymalnym scenariuszu miejscowo podany lek jest uwalniany stopniowo, dodatkowo zwiększając efektywność terapii. Właśnie taki model działania został zaproponowany w materiale opracowanym na UJ.
Wynalazek został objęty ochroną patentową na terenie Polski i zagranicą.