Immunologia a SARS-CoV-2. Co wiemy
Zrozumienie kluczowych cech i rozwoju odporności na SARS-CoV-2 jest niezbędne do prognozowania rozwoju COVID-19 oraz do opracowania skutecznych strategii ochrony zdrowia publicznego, które nie będą ograniczone tylko do zwalczania pandemii.
Foto: pixabay.com
W ponad dziewięć miesięcy od początku wybuchu pandemii rozumienie odpowiedzi immunologicznej na SARS-CoV-2 jest wciąż niepełne, ale wiemy znacznie więcej niż kilka miesięcy temu.
Pierwsza reakcja na pojawienie się zakażeń, którym towarzyszyły dramatyczne obrazy z Włoch i Hiszpanii, była bardzo gwałtowna, prawie paniczna. Mimo umiarkowanej liczby zakażeń, prawie cała Europa i większość krajów świata wprowadziła bardzo restrykcyjne ograniczenia; tzw. lockdown.
Skutkiem tego stanu, trwającego przez około trzy miesiące, był bezprecedensowy spadek aktywności gospodarczej, blokada działalności wielu instytucji, w tym ochrony zdrowia, ogromny przyrost zadłużenia publicznego oraz poważne naruszenie równowagi społecznej. W rezultacie pojawiły się głosy, że sposób „leczenia” problemu SARS-CoV-2 może być gorszy od samej „choroby”. Obecnie, po wcześniejszych doświadczeniach, oraz mimo że poziom zakażeń jest wyższy niż wiosną, władze nie zamierzają wprowadzać lockdownu.
Wskazuje się na potrzebę bardziej celowanych i ograniczonych działań, wykorzystujących wiedzę o wirusie, którą już nabyliśmy. Poniżej podsumowałem stan wiedzy na temat nabywania odporności na SARS-CoV-2. Wiedza ta, która stale się rozwija, może posłużyć do planowania działań redukujących ryzyko, jednocześnie pozwalając na zachowanie głównych funkcji współczesnych społeczeństw. W szczególności wiedza ta powinna być przedstawiana osobom, które na co dzień z immunologią i wirusologią nie mają do czynienia, ale mają wpływ na decyzje oddziałujące na szeroko pojęte zdrowie publiczne.
Stan wiedzy
Liczba osób, które przeszły zakażenie, rośnie. Badania seroprewalencji wskazały, że największe rozpowszechnienie zakażeń w ostatnich miesiącach zidentyfikowano w takich miejscach jak Indie (Mumbay, slamsy) – 58,4 proc., Argentyna (Barrio Padre) – 53,4 proc., Brazylia (Maranhao) – 40,4 proc. W Europie zidentyfikowano ok. 20 proc. osób seropozytywnych w populacji w Gangelt, (Niemcy), 10,9 proc. w Genewie i 5-6 proc. średnio w populacji Hiszpanii i Wielkiej Brytanii (1). Jednocześnie stwierdza się, że tylko niewielka część osób, u których dochodzi do zakażenia i wytworzenia specyficznych przeciwciał, jest wykrywana w ramach systemów wykrywania zakażeń przy zastosowaniu testów PCR: w badaniach amerykańskich jest to ok. 10 proc. (2; 3; 4).
Początkowa niepewność co do modelu serokonwercji w zakażeniu SARS-CoV-2 stopniowo jest usuwana. Ustalono, że w schemacie odpowiedzi immunologicznej główną rolę odgrywają limfocyty typu T (grasicozależne); wśród nich szczególnie te z antygenami CD8+, odpowiedzialne za niszczenie komórek zainfekowanych przez wirusa (killer), oraz z antygenami CD4+ (helper), wspomagające odpowiedź immunologiczną m.in. poprzez aktywację limfocytów B. Badania wielu znaczących zespołów naukowych pozwoliły ustalić, że odpowiedź organizmu następuje w ciągu pierwszych 7-10 dni od momentu zakażenia (5; 6; 7), w postaci ekspansji limfocytów B (6; 8), krótko po tym pojawiają się w surowicy przeciwciała IgM i IgA (dzień 5 do 7) i IgG (dzień 7 do 10).
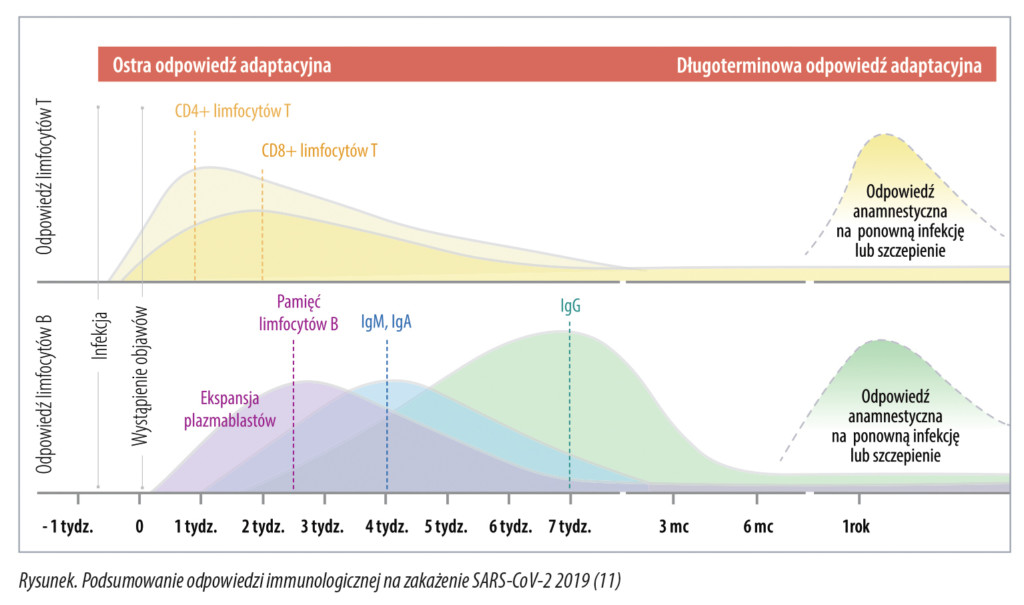
Po około 28 dniach miano IgM i IgA w surowicy spada, a miano IgG osiąga szczyt średnio po ok. 49 dniach i utrzymuje się przez co najmniej sześć miesięcy (9). Jednocześnie, w pierwszym tygodniu infekcji SARS-CoV-2, uaktywniają się limfocyty T, a specyficzne dla wirusa limfocyty T CD4+ i limfocyty T CD8+ prawdopodobnie osiągają szczyt w ciągu dwóch tygodni i pozostają wykrywalne przez 100 lub więcej dni obserwacji. Limfocyty T CD4+ swoiste dla SARS-CoV-2 zidentyfikowano nawet u 100 proc., a limfocyty T CD8+ u około 70 proc. pacjentów, którzy wyzdrowieli z COVID-19 (5; 9; 10). Rysunek przedstawia uogólniony model odpowiedzi limfocytów T oraz limfocytów B na zakażenie SARS-CoV-2, prognozowany na okres ponad rok po zakażeniu, a także przeciwciał IgM, IgA i IgG.
Linie pionowe przerywane przedstawiają szczytowe punkty odpowiedzi limfocytów B, T i przeciwciał. Dotychczas stwierdzono, że jedną ze ścieżek rozwoju odporności jest produkcja przeciwciał neutralizujących, szczególnie tych, które rozpoznają domenę wiążącą receptor wirusa (receptor binding domain, RBD), a także inne epitopy na tzw. białku kolca (podjednostka S1). Przeciwciała neutralizujące więżą się z białkiem kolca, zapobiegają przyłączeniu się do receptora enzymu konwertującego angiotensynę typu drugiego (ACEII) i przedostaniu się wirusa do wnętrza komórki. Miano przeciwciał IgG i IgA anty-SARS-CoV-2 przeciwko białku kolca koreluje u rekonwalescentów z odpowiedzią limfocytów T CD4+ (6), a wielkość miana przeciwciał podklas IgG1 i IgG3 przeciw RBD silnie koreluje z neutralizacją wirusa (6; 7; 12). Na poziomie klinicznym wykazano, że obecność przeciwciał neutralizujących chroni przed zakażeniem (13).
Wobec takich obserwacji wytwarzanie neutralizujących przeciwciał skierowanych przeciwko białku kolca stało się podstawą wielu szczepionek przeciw SARS-CoV-2, testowanych obecnie w badaniach klinicznych (14; 15). Neutralizacja wirusa jest także mechanizmem działania przeciwciał monoklonalnych, testowanych pod kątem ich roli terapeutycznej i prewencyjnej. Wykazano, że takie przeciwciała działają ochronnie w zwierzęcych modelach zakażenia SARS-CoV-2. Silna odpowiedź w postaci przeciwciał neutralizujących i limfocytów T CD4+ (konwertujących w limfocyty Th1), skierowana na białko kolca chroni przed zakażeniem SARS-CoV-2 (drogą przez płuca i błonę śluzową nosa) u zwierząt z rzędu naczelnych (makaków) (16).
Potencjalne zmiany w białku kolca SARS-CoV-2 (np. D614G) mogłyby powodować nietrwałość uodpornienia. Uważa się jednak, że SARS-CoV-2 ma raczej niski współczynnik zmienności i jak dotąd nie wykazano, że takie zmiany zmniejszają rozpoznawanie epitopów RBD ważnych dla produkcji przeciwciał neutralizujących, choć nie można tego wykluczyć w przyszłości. Siła odpowiedzi immunologicznej może być różna u poszczególnych osób i zależy od stopnia nasilenia choroby (bezobjawowa, łagodna, umiarkowana lub ciężka), a także cech osobniczych. Poza tym, w miarę upływu czasu miano przeciwciał neutralizujących IgG spada, co budzi obawy o możliwość pojawienia się ponownych zakażeń wirusem SARS-CoV-2. W ostatnich badaniach wykazano, że IgG przeciw białku kolca utrzymują się co najmniej sześć miesięcy (17).
Gdy te aktywne składniki odpowiedzi immunologicznej zanikną, pamięć serologiczna jest utrzymywana przez komórki plazmatyczne, które znajdują się w szpiku kostnym i produkują przeciwciała mimo nieobecności antygenów. Wykazano, że komórki pamięci immunologicznej, krążące we krwi po zaniku przeciwciał, mają możliwość wytworzenia silnej odpowiedzi w postaci przeciwciał neutralizujących (7). Zatem spadek poziomu przeciwciał neutralizujących nie oznacza zaniku odporności, a jedynie jej zmniejszenie i opóźnienie reakcji. Odpowiednie miano przeciwciał można przywróć po ponownym naturalnym zakażeniu lub doszczepieniu.
Ważnym pytaniem jest, ile czasu zajmuje organizmowi uruchomienie komórki pamięci na tyle skutecznie, by miano przeciwciał neutralizujących pozwoliło na blokadę namnażania wirusa, na co obecnie nie ma jednak odpowiedzi. Intensywność ekspozycji na antygen jest głównym czynnikiem wpływającym na wielkość odpowiedzi immunologicznej, stąd najwyższe miana przeciwciał neutralizujących występują w przypadku ciężkiego przebiegu choroby (7), choć nie można wykluczyć innych powodów tej zmienności. W przypadku koronawirusów przeziębienia (229E), przeciwciała IgG i IgA zanikały w ciągu pierwszego roku po infekcji wirusowej nosa (18).
Po ponownym eksperymentalnym podaniu tego samego szczepu 229E po roku, żadna osoba, która była wcześniej zakażona, nie zachorowała na przeziębienie i wszystkie miały krótszy czas wykrywalnego rozsiewania wirusa. Można przypuszczać, że odporność na kliniczną postać COVID-19 może zostać utrzymana, pomimo zaniku przeciwciał. W badaniu na makakach zakażenie SARS-CoV-2 chroni przed ponownym zakażeniem (19). U ludzi, po ponad dziewięciu miesiącach od wybuchu epidemii i po 50 milionach infekcji na całym świecie, pojawia się niewielka liczba przypadków ponownej infekcji, przy czym znaczna część z nich jest wątpliwa (20).
Chociaż ludzka odpowiedź immunologiczna może nie zapewniać odporności sterylizującej (jak to ma miejsce w przypadku odry), to jednak może skrócić okres usuwania wirusa, zmniejszyć rozprzestrzenianie się i zapobiegać rozwojowi pełnoobjawowej choroby, choć zdarzają się także pojedyncze doniesienia o sytuacji odwrotnej (20). Specyficzne dla SARS-CoV-2 limfocyty T CD4+ i CD8+ są produkowane tak w przebiegu choroby bezobjawowej, jak pełnoobjawowej (5; 9; 10). Wykazują one aktywność cytotoksyczną i produkują cytokiny przeciwwirusowe, czyli mają cechy, które pozwalają kontrolować namnażanie wirusa i zapobiegać nawracającym ciężkim zakażeniom. U osób z łagodną lub bezobjawową chorobą wykazano silną odpowiedź limfocytów T na wiele miesięcy po zakażeniu COVID-19, chociaż nie wiadomo, czy przy braku wykrywalnych krążących przeciwciał chronią one przed SARS-CoV-2. Region RBD białka kolca wykazuje pewne podobieństwo z koronawirusami sezonowymi (6).
Z tym prawdopodobnie wiąże się istnienie odpowiedzi immunologicznej na SARS-CoV-2, występującej u dawców krwi sprzed pandemii COVID-19, jak i pośród osób, które nie przechodziły zakażenia (5; 9; 10). Ta odpowiedź angażuje częściej limfocyty T CD4+ niż CD8 + i prawdopodobnie wynika z wcześniejszych zakażeń innymi ludzkimi koronawirusami, tzw. wirusami przeziębienia. Limfocyty T skierowane przeciw SARS-CoV-2 są również obserwowane u zdrowych domowników osób zakażonych. Istnieją przesłanki, by sądzić, że pewne limfocyty T, sprofilowane w trakcie poprzednich zakażeń koronawirusem, po ograniczonej ekspozycji na SARS- -CoV-2 mogą być szybko mobilizowane do zwalczania SARS-CoV-2.
Po ośmiu miesiącach od wybuchu epidemii w Europie zbliża się rejestracja szczepionek p/SARS-CoV-2. Mechanizm uzyskania odporności poszczepiennej prawdopodobnie będzie obejmować indukcję limfocytów pomocniczych T CD4+ oraz będzie wymagać szczepień przypominających (14; 21). Dodatkowo możliwe, że konieczne stanie się badanie poziomu przeciwciał neutralizujących anty-SARS-CoV-2 w celu potwierdzenia skuteczności szczepienia. W szczególności może to być konieczne z uwagi na tempo prowadzenia badań. Zwykle opracowywanie nowych szczepionek to proces wieloletni, w przypadku SARS-CoV-2 oczekujemy wyników tych prac już po roku od ich uruchomienia (22).
Wnioski
Wiedza na temat wirusa SARS-CoV-2 i wywoływanej przez niego choroby COVID-19 szybko rośnie. Do pełnej wiedzy, pewności oraz przewidywalności wciąż jest daleko, jednak skala oddziaływania pandemii na społeczeństwo powoduje, że musimy podejmować decyzje w oparciu o informacje już posiadane. Stąd tak istotne jest, by powiększanie puli wiedzy w szybki i sprawny sposób inkorporować do działania instytucji odpowiedzialnych za zdrowie publiczne w Polsce, a także do wytycznych klinicznych powołanych do tego gremiów.
Po niecałym roku od początku pandemii już widać dewastujące skutki tak samej pandemii, jak i działań, które mają ją powstrzymać. Wydaje się, że dotychczasowy przekaz publiczny był zbyt rozchwiany: od paniki i masowego blokowania życia społecznego do banalizowania i zaprzeczania istnienia problemu. W dalszym ciągu wydaje się, że jako społeczeństwo jesteśmy w defensywie, pomimo że obecny stan wiedzy pozwala z pewnym optymizmem patrzeć na stopniowe budowanie odporności na zakażenie u osób, które je przeszły, a których może być w Polsce kilka milionów. Szczepienie populacji powinno wspomóc ten proces, poczynając od pierwszego kwartału 2021 r.
Trzeba mieć jednak świadomość, że przyszła szczepionka nie będzie dostępna powszechnie w krótkim czasie, nie będzie oferować pewności uodpornienia, ani jego pełnej trwałości. W tej sytuacji zarządzanie uodpornieniem populacji, jakkolwiek ryzykownie by to brzmiało, pozostanie jedynym sposobem na uniknięcie totalnej blokady z wszystkimi skutkami tego stanu. Osoby zajmujące się szeroko pojętym zdrowiem publicznym powinny pamiętać i dbać o stan zdrowia populacji nie tylko ten wynikający bezpośrednio z zakażenia SARS-CoV-2, ale także pamiętać o zagrożeniu zawałami serca, o chorych na nowotwory oraz tych z zaburzeniami psychicznymi, z nadużywaniem substancji pchychoaktywnych na czele.
Dr n. med. Adam Kozierkiewicz, ekspert ds. ekonomiki zdrowia
Bibliografia
1. Ioannidis J. Infection fatality rate of COVID-19 inferred from seroprevalence data. Bulletin of the World Health Organization. https://www.who.int/bulletin/online_first/BLT.20.265892.pdf, 13 September 2020.
2. Anand S., Montez M., Han J. et al. . Prevalence of SARS-CoV-2 antibodies in a large nationwide sample of patients on dialysis in the USA: a cross-sectional study. thelancet.com. [Online] 25 Sept 2020. https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)32009-2/fulltext.
3. Rosenberg ES, Tesoriero JM, Rosenthal EM, et al., . Cumulative incidence and diagnosis of SARS-CoV-2 infection in New York.,. Ann Epidemiol. 2020; 48: 23-29.e4.
4. Havers F, Reed C, Lim T, et al., . Seroprevalence of antibodies to SARS-CoV-2 in six sites in the United States,. March 23-May 3, 2020. , Vol. medRxiv. 2020; (published online June 26.) (preprint) , https://doi.org/10.1101/2020.06.25.20140384v1.
5. Grifoni A, Weiskopf D, Ramirez SI, et al. Targets of T cell responses to SARS-CoV-2 coronavirus in Humans with COVID-19 disease and unexposed individuals. Cell. 2020;181(7):1489-1501.e15. doi:10.1016/j.cell.2020.05.015. 2020.
6. Suthar MS, Zimmerman MG, Kauffman RC, et al. Rapid generation of neutralizing antibody responses in COVID-19 patients. Cell Rep Med. 2020;1(3):100040. Published online June 23, 2020. doi:10.1016/j.xcrm.2020.100040. 2020.
7. Robbiani DF, Gaebler C, Muecksch F, et al. Convergent antibody responses to SARS-CoV-2 in convalescent individuals. . Nature. Published online June 18, 2020. doi:10.1038/s41586-020-2456-9. 2020.
8. Mathew D, Giles JR, Baxter AE, et al. UPenn COVID Processing Unit. Deep immune profiling of COVID-19 patients reveals distinct immunotypes with therapeutic implications. . Science. Published online July 15, 2020. 2020.
9. Le Bert N, Tan AT, Kunasegaran K, et al. SARS-CoV-2-specific T cell immunity in cases of COVID-19 and SARS, and uninfected controls. Nature. Published online July 15, 2020. doi:10.1038/s41586-020-2550-z. 2020.
10. Braun J, Loyal L, Frentsch M, et al. SARS-CoV-2-reactive T cells in healthy donors and patients with COVID-19. Nature. Published online July 29, 2020. 2020.
11. Stephens D, McElrath, JM,. COVID-19 and the Path to Immunity. JAMA, . 2020. doi:10.1001/jama.2020.1665, Vols. September 11, 6.
12. Ni L., Ye F., Cheng M. et al. . Detection of SARS-CoV-2-Specific Humoral and Cellular Immunity in COVID-19 Convalescent Individuals. Immunity. VOLUME 52, ISSUE 6, P971-977.E3, JUNE 16, 2020.
13. Addetia A, Crawford K., Dingens A, et al. . Neutralizing Antibodies Correlate with Protection from SARS-CoV-2 in Humans during a Fishery Vessel Outbreak with a High Attack Rate. Journal of Clinical Microbiology. 21 August 2020., 2020.
14. O’Callaghan KP, Blatz AM, Offit PA. Developing a SARS-CoV-2 vaccine at warp speed. JAMA. 2020;324(5):437-438. doi:10.1001/jama.2020.12190. 2020.
15. Poland G., Ovyannikova I, Kennedy R., . SARS-CoV-2 immunity: review and applications to phase 3 vaccine candidates. The Lancet Journal. October 13, 2020, https://doi.org/10.1016/S0140-6736(20)32137-1.
16. Corbett KS, Flynn B, Foulds KE, et al. Evaluation of the mRNA-1273 vaccine against SARS-CoV-2 in nonhuman primates. . N Engl J Med. Published online July 29,. 2020.
17. Dan J, Mateus J., Kato Y, Hastie K, Faliti C, Ramirez S, (et al.) . Immunological memory to SARS-CoV-2 assessed for greater than six months after infection. ttps://www.biorxiv.org/content/10.1101/2020.11.15.383323v1, bioRxiv 2020.11.15.383323; doi: https://doi.org/10.1101/2020.11.15.383323.
18. Callow KA, Parry HF, Sergeant M, Tyrrell DA. The time course of the immune response to experimental coronavirus infection of man. Epidemiol Infect. 1990;105(2):435-446. doi:10.1017/S0950268800048019. 1990.
19. Deng W, Bao L, Liu J, et al. Primary exposure to SARS-CoV-2 protects against reinfection in rhesus macaques. Science. 2020;369(6505):818-823. Published online July 2, 2020. doi:10.1126/science.abc5343. 2020.
20. de Vrieze J. More people are getting COVID-19 twice, suggesting immunity wanes quickly in some. ScienceMar.org. Nov. 18, 2020 , https://www.sciencemag.org/news/2020/11/more-people-are-getting-covid-19-twice-suggesting-immunity-wanes-quickly-some.
21. Nature. Why decoding the immune response to COVID matters for vaccines? Nature. 586, 473-474 (2020), https://www.nature.com/articles/d41586-020-02943-9.
22. WHO. What we know about COVID-19 vaccine development. [Online] WHO, 6 Oct. 2020. https://www.who.int/docs/default-source/coronaviruse/risk-comms-updates/update37-vaccine-development.pdf?sfvrsn=2581e994_6.




















